Кампат
Информацията В Сайта Не Е Медицински Съвет. Ние Не Продаваме Нищо. Точността На Превода Не Е Гарантирана. Отказ От Отговорност
Резюме на наркотиците
Какво е Кампат?
Campath (Alemtuzumab) е антитяло, направено от животинска ДНК, използвана за лечение на хронична лимфоцитна левкемия. Кампатът обикновено се дава след като други лекарства са били изпробвани без успешно лечение.
Какви са страничните ефекти на Campath?
Campath може да причини сериозни странични ефекти, включително:
- кошери
- затруднено дишане
- Подуване на лицето ви устни Език или гърло
- треска
- втрисане
- гадене
- Лекоглавия
- обрив
- хрипове
- Болки в гърдите
- Проблеми с речевата мисъл зрение или движението на мускулите
- Лесно синини
- необичайно кървене
- лилави или червени петна под кожата ви
- Мани от уста
- Кожни рани
- възпалено гърло
- кашлица
- Бледа или пожълтяла кожа
- Тъмно оцветена урина
- объркване
- необичайна слабост
- задух
- студени ръце и крака
- Подуване в долните крака
- наддаване на тегло
- загуба на апетит
- Внезапна болка в стомаха или гърба и
- урина, която изглежда розово кафява или пенеста
Получете медицинска помощ веднага, ако имате изброени по -горе симптоми.
Общите странични ефекти на Campath включват:
- треска
- втрисане
- замаяност
- мускулна скованост
- ставна или мускулна болка
- гадене
- повръщане
- загуба на апетит
- коремна болка
- главоболие
- диария
- обрив or itching
- кошери
- умора
- Проблеми със съня (безсъние)
- безпокойство
- умора
- кашлица
- изпотяване или
- Проблем с дишането по време на или след инфузията.
Тези странични ефекти се появяват по -често през първата седмица на лечение с Кампат. Кажете на Вашия лекар, ако имате сериозни странични ефекти на Campath, включително:
- задух
- Психични/промени в настроението (като тревожност за депресия)
- кост или Болки в гърба
- мускулен спазъм
- необичайна слабост
- Подуване на глезените или краката
- Пожълтяваща кожа или очи
- Промени в количеството на урината
- болезнено уриниране
- розова или кървава урина
- изтръпване или изтръпване на ръце или крака или
- Болка/зачервяване/подуване на ръцете/краката/мястото на инжектиране.
Потърсете медицинска помощ или се обадете на 911 наведнъж, ако имате следните сериозни странични ефекти:
- Сериозни симптоми на очите, като например внезапна загуба на зрение, замъглено зрение Тунел Виждане болка в очите или подуване или виждане на ореоли около светлините;
- Сериозни сърдечни симптоми като бързи нередовни или ударни сърдечни удари; трептене в гърдите ви; задух; и внезапна замаяност замаяност или раздаване;
- Тежка главоболие объркване затънала речева ръка или крак слабост проблем за ходене на загуба на координация, чувствайки се нестабилни много твърди мускули висока треска обилно изпотяване или тремор.
Този документ не съдържа всички възможни странични ефекти, а други могат да възникнат. Консултирайте се с вашия лекар за допълнителна информация за страничните ефекти.
Дозировка за Кампат
Лекарството на Campath се прилага интравенозно под надзора на лекар обикновено над 2 часа. Дозировката се основава на реакцията на пациента на лечението. Пациентите обикновено започват с ниска доза на лекарството и дозата може бавно да се увеличи.
Какви лекарства вещества или добавки взаимодействат с Campath?
Други лекарства могат да повлияят на Кампат. Кажете на Вашия лекар за всички лекарства за рецепта и без рецепта, които използвате. Това включва витамини минерали билкови продукти и лекарства, предписани от други лекари. Не започвайте да използвате ново лекарство, без да казвате на вашия лекар.
Нормална доза риталин за възрастни
Кампат по време на бременност и кърмене
По време на бременността Кампат трябва да се използва само когато е предписано. Препоръчва се мъжете и жените да получават това лекарство да използват най -малко 2 форми на контрол на раждаемостта (например хапчета за контрол на раждаемостта) по време на лечението с това лекарство и поне 6 месеца след това. Не е известно дали това лекарство преминава в кърма. Поради възможния риск за кърменето на бебето по време на употребата на това лекарство не се препоръчва по време на лечението с това лекарство и поне 3 месеца след това.
Допълнителна информация
Нашият лекарствен център Campath (Alemtuzumab) предоставя изчерпателен поглед върху наличната информация за лекарството върху потенциалните странични ефекти при приемането на това лекарство.
Информация за наркотиците на FDA
- Описание на лекарството
- Показания
- Странични ефекти
- Предупреждения
- Предозиране
- Клинична фармакология
- Ръководство за лекарства
Предупреждение
Реакции и инфекции с инфузия на цитопения
Цитопении
Сериозно, включително фатална пансипения/мозъчна хипоплазия Автоимунна идиопатична тромбоцитопения и автоимунна хемолитична анемия може да се появи при пациенти, получаващи кампус. Единични дози на Кампат по -големи от 30 mg или кумулативни дози над 90 mg седмично увеличават честотата на паситопенията [виж предупрежденията и ПРЕДПАЗНИ МЕРКИ ].
Инфузионни реакции
Прилагането на Campath може да доведе до сериозни, включително фатални реакции на инфузия. Внимателно наблюдавайте пациентите по време на инфузии и задържайте Campath за реакции на инфузия 3 или 4 степен. Постепенно ескалирам Кампат до препоръчителната доза при започване на терапия и след прекъсване на терапията в продължение на 7 или повече дни [виж Доза и приложение и предупреждения и ПРЕДПАЗНИ МЕРКИ ].
Инфекции
Сериозно, включително фатални бактериални вирусни гъбички и протозойни инфекции, могат да се появят при пациенти, получаващи кампус. Администриране на профилактика срещу пневмоцистис jiroveci пневмония (PCP) и инфекции с вируса на херпес [виж Доза и приложение и предупреждения и ПРЕДПАЗНИ МЕРКИ ].
Описание за Campath
Campath (Alemtuzumab) е рекомбинантно ДНК-произведено хуманизирано моноклонално антитяло (Campath-1H), насочено срещу 21–28 kD клетъчна повърхностно гликопротеин CD52. Campath-1H е IgG1 kappa антитяло с рамка на променлива човешка и постоянни региони и комплементарно определяне на региони от моноклонално антитяло на миши (плъхове) (Campath-1G). Campath-1H антитялото има приблизително молекулно тегло от 150 kD. Campath се произвежда в културата на суспензия на клетките на бозайници (китайски хамстер) в среда, съдържаща неомицин. Неомицинът не се открива в крайния продукт.
Campath е стерилен чист безцветен изотонен разтвор (pH 6.8–7.4) за инжектиране. Всеки флакон за еднократна употреба на Кампат съдържа 30 mg alemtuzumab 8,0 mg натриев хлорид 1,44 mg дибазичен натриев фосфат 0,2 mg калиев хлорид 0,2 mg монобазен калиев фосфат 0,1 mg полисорбат 80 и 0,0187 mg дисорий едотат дихидрат. Не се добавят консерванти.
Използване за Campath
Campath е показан като единичен агент за лечение на В-клетъчна хронична лимфоцитна левкемия (B-CLL).
Дозировка за Кампат
График за дозиране и администрация
- Прилагайте като интравенозна инфузия за 2 часа. Не администрирайте като интравенозно натискане или болус.
- Препоръчителен режим на дозиране
- Постепенно ескалира до максималната препоръчителна единична доза от 30 mg. Необходимо е ескалация при започване на дозиране или ако дозирането се провежда ≥7 дни по време на лечението. Ескалацията до 30 mg обикновено може да се осъществи за 3 до 7 дни.
- Стратегия за ескалация
- Администрирайте 3 mg дневно, докато реакциите, свързани с инфузията, са ≤ степен 2 [виж Нежелани реакции ].
- След това прилагайте 10 mg дневно, докато реакциите, свързани с инфузията, не са ≤ степен 2.
- След това администрирайте 30 mg/ден три пъти седмично в алтернативни дни (напр. Mon-Wed-FRI). Общата продължителност на терапията, включително ескалация на дозата, е 12 седмици.
- Единичните дози над 30 mg или кумулативни дози над 90 mg седмично увеличават честотата на паситопения.
Препоръчителни съпътстващи лекарства
- Премикално с дифенхидрамин (50 mg) и ацетаминофен (500-1000 mg) 30 минути преди първата инфузия и всяка ескалация на дозата. Институт подходящ медицински мениджмънт (например глюкокортикоиди епинефрин меперидин) за реакции, свързани с инфузия, ако е необходимо [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ и Нежелани реакции ].
- Администрирайте триметоприм/сулфаметоксазол двойна сила (DS) два пъти дневно 3 пъти седмично (или еквивалентно) като пневмоцистис jirovecii pneumonia (PCP) профилактика.
- Администрирайте Famciclovir 250 mg оферта или еквивалентно като херпетична профилактика.
Продължете PCP и херпес вирусна профилактика за минимум 2 месеца след приключване на Campath или докато броят на CD4 е ≥200 клетки/μl, който се случи по -късно [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ ].
Модификация на дозата
- Задържайте кампуса по време на сериозна инфекция или други сериозни нежелани реакции до разрешаване.
- Прекратяване на Кампат за автоимунна анемия или автоимунна тромбоцитопения.
- Не се препоръчват модификации на дозата за лимфопения.
Модификация на дозата за неутропения или тромбоцитопения [виж Предупреждения и предпазни мерки]
| Хематологични стойности | Модификация на дозата* |
| Anc <250/μL и/or platelet count ≤25000/μL | |
| За първо събитие: | Задържайте терапията на кампуса. Възобновете кампата при 30 mg, когато ANC ≥500/μL и броя на тромбоцитите ≥50000/μL. |
| За второ събитие: | Задържайте терапията на кампуса. Възобновете кампата при 10 mg, когато ANC ≥500/μL и броя на тромбоцитите ≥50000/μL. |
| За трето събитие: | Прекратяване на терапията на Кампат. |
| > 50% намаление от изходната линия при пациенти, иницииращи терапия с изходна ANC ≤250/μL и/или базов брой на тромбоцитите ≤25000/μl | |
| За първо събитие: | Задържайте терапията на кампуса. Възобновете Campath при 30 mg при завръщане към базовата стойност (и). |
| За второ събитие: | Задържайте терапията на кампуса. Възобновете Кампат при 10 mg при завръщане към базовата стойност (и). |
| За трето събитие: | Прекратяване на терапията на Кампат. |
| * Ако забавянето между дозирането е ≥7 дни, инициира терапия в кампуса 3 mg и ескалира до 10 mg и след това до 30 mg като поносимо [виж Доза и приложение ]. |
Подготовка и администриране
Парентералните лекарствени продукти трябва да бъдат инспектирани визуално по прахови частици и обезцветяване преди администрирането. Ако присъства прахови частици или разтворът се обезцвети флакона. Не разклащайте флакона.
Използвайте асептична техника по време на подготовката и прилагането на Campath. Изтеглете необходимото количество кампур от флакона в спринцовка.
- За приготвяне на 3 mg дозата оттегляне 0,1 ml в 1 ml спринцовка, калибрирана на стъпки от 0,01 ml.
- За да приготвите 10 mg дозата оттегляне 0,33 ml в 1 ml спринцовка, калибрирана на стъпки от 0,01 ml.
- За да се приготви дозата от 30 mg оттегляне 1 ml в 1 ml или 3 ml спринцовка, калибрирана на стъпки от 0,1 ml.
Съдържание на инжектиране на спринцовка в 100 ml стерилен 0,9% натриев хлорид USP или 5% декстроза във вода USP. Внимателно обърнете торбата, за да смесите разтвора. Изхвърлете спринцовката.
Флаконът не съдържа консерванти и е предназначен само за еднократна употреба. Изхвърлете флакона, включително всяка неизползвана част след изтегляне на дозата.
Използвайте в рамките на 8 часа след разреждане. Съхранявайте разреден кампур при стайна температура между 15 ° C до 30 ° C (59 ° F до 86 ° F) или хладилник при 2 ° C до 8 ° C (36 ° F до 46 ° F). Предпазва от светлина.
Несъвместимости
Campath е съвместим с торбички с поливинилхлорид (PVC) и PVC или набори от администрация на PVC, облицовани с полиетилен. Не добавяйте или едновременно вливайте други лекарствени вещества през една и съща интравенозна линия.
Колко се доставя
Дозирани форми и силни страни
Инжектиране : 30 mg/1 ml като ясен безцветен разтвор във флакон с една доза
Съхранение и обработка
Кампат (Alemtuzumab) се доставя в прозрачен стъклен флакон с една доза, съдържащ 30 mg алемтузумаб в 1 ml разтвор. Всяка картонена опаковка съдържа три флакона на Кампат ( NDC 58468â0357-3) или един флакон с Кампат ( NDC 58468-0357-1).
AVAR лекарства
Съхранявайте Campath при 2 ° C до 8 ° C (36 ° F до 46 ° F). Не замръзвайте. Ако случайно замразява размразяване при 2 ° C до 8 ° C преди прилагане. Предпазвайте от пряка слънчева светлина.
Произведено и разпространено от: Genzyme Corporation Cambridge MA 02142 Номер на лиценза на САЩ: 1596. Ревизиран: април 2023 г.
Странични ефекти за Кампат
Следните клинично значими нежелани реакции са разгледани по -подробно в други раздели на етикета:
- Цитопении [see ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ ]
- Реакции, свързани с инфузия [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ ]
- Имуносупресия/инфекции [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ ]
Опит с клинични изпитвания
Тъй като клиничните изпитвания се провеждат при широко различни състояния, нежелани реакционни проценти, наблюдавани при клиничните изпитвания на лекарство, не могат да бъдат пряко сравнени със проценти в клиничните изпитвания на друго лекарство и може да не отразяват процентите, наблюдавани на практика.
Данните по -долу отразяват излагането на Кампат при 296 пациенти с CLL, от които 147 не са били нелекувани и 149 са получили поне 2 предишни режима на химиотерапия. Средната продължителност на експозицията е 11,7 седмици за нелекувани по -рано пациенти и 8 седмици за пациенти, лекувани преди това.
The most common adverse reactions with CAMPATH are: infusion-related reactions (pyrexia chills hypotension urticaria nausea rash tachycardia dyspnea) cytopenias ( neutropenia lymphopenia thrombocytopenia anemia) infections (CMV viremia CMV infection other infections) gastrointestinal symptoms (nausea emesis abdominal pain) and neurological Симптоми (безпокойство от безсъние). Най-често срещаните сериозни нежелани реакции са реакции, свързани с инфузия на цитопения, и имуносупресия/инфекции.
Лимфопения
Тежка лимфопения и бързо и устойчиво намаляване на подмножествата на лимфоцитите се наблюдават при нелекувани по -рано и преди това пациенти след прилагане на Campath. При нелекувани по-рано пациенти средният CD4 е 0 клетки/μL за един месец след лечението и 238 клетки/μL [25% -75% интерквартилен диапазон 115 до 418 клетки/μL на 6 месеца след лечението [виж [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ ].
Неутропения
При нелекувани по -рано пациенти честотата на 3 или 4 неутропения е била 42% със средно време до началото на 31 дни и средна продължителност от 37 дни. При по -рано лекувани пациенти честотата на 3 или 4 неутропения е 64% при средна продължителност 28 дни. Десет процента от нелекуваните по -рано пациенти и 17% от по -рано лекуваните пациенти са получили стимулиращи фактори на гранулоцитна колония.
Анемия
При нелекувани по -рано пациенти честотата на 3 или 4 анемия е 12% със средно време до настъпване от 31 дни и средна продължителност от 8 дни. При по -рано лекувани пациенти честотата на анемия от 3 или 4 е 38%. Седемнайсет процента от нелекуваните по -рано пациенти и 66% от преди това лекуваните пациенти са получили или еритропоеза, стимулиращи трансфузии, или и двете.
Тромбоцитопения
При нелекувани по -рано пациенти честотата на 3 или 4 тромбоцитопения е 14% със средно време до началото на 9 дни и средна продължителност от 14 дни. При по -рано лекувани пациенти честотата на 3 или 4 тромбоцитопения е 52% при средна продължителност 21 дни. Автоимунната тромбоцитопения се съобщава при 2% от по -рано лекуваните пациенти с една фаталност.
Реакции, свързани с инфузия
Реакциите, свързани с инфузия, включващи хипотония на пирексия, хипотония уртикария и диспнея, са често срещани. 3 и 4 пирексия и/или втрисане се наблюдават при приблизително 10% от нелекуваните преди това пациенти и при приблизително 35% от лекуваните преди това пациенти. Появата на реакции, свързани с инфузия, е най-голяма през първоначалната седмица на лечение и намалява с последващи дози на Кампат. Всички пациенти бяха предварително обработени с антипиретици и антихистамини; Освен това 43% от нелекуваните по -рано пациенти са получили глюкокортикоидна предварителна обработка.
Инфекции
В проучването на нелекувани по -рано пациенти пациенти са тествани седмично за CMV, използвайки PCR анализ от започване чрез завършване на терапията и на всеки 2 седмици за първите 2 месеца след терапията. CMV инфекция се наблюдава при 16% (23/147) от нелекувани преди това пациенти; Приблизително една трета от тези инфекции бяха сериозни или животозастрашаващи. В проучвания на лекувани по -рано пациенти, при които рутинното наблюдение на CMV не се изисква CMV инфекция, е документирана при 6% (9/149) от пациентите; Почти всички тези инфекции бяха сериозни или животозастрашаващи.
Други инфекции са съобщени при приблизително 50% от пациентите във всички проучвания. 3 до 5 сепсис варира от 3% до 10% в различните проучвания и е по -висок при по -рано лекувани пациенти. 3 до 4 фебрилна неутропения варира от 5% до 10% в различните проучвания и е по -висока при лекувани преди това пациенти. Смъртните случаи, свързани с инфекцията, се наблюдават при 2% от нелекуваните преди това пациенти и 16% от лекуваните преди това пациенти. Има 198 епизода на друга инфекция при 109 нелекувани по -рано пациенти; 16% са бактериални 7% са гъбични 4% са други вирусни, а при 73% организмът не е идентифициран.
Сърдечен
Сърдечен dysrhythmias occurred in approximately 14% of previously untreated patients. The majority were tachycardias и were temporally associated with infusion; dysrhythmias were Grade 3 or 4 in 1% of patients.
Преди това нелекувани пациенти
Таблица 1 съдържа избрани нежелани реакции, наблюдавани при 294 пациенти, рандомизирани (1: 1) за получаване на кампус или хлорамбуцил като терапия от първа линия за B-CLL. Кампатът се прилага при доза 30 mg интравенозно три пъти седмично за до 12 седмици. Средната продължителност на терапията е 11,7 седмици със средна седмична доза от 82 mg (25% -75% интерквартилен диапазон: 6990 mg).
Таблица 1: При честота на пациента на избрани* нежелани реакции при лечение наивни пациенти с B-Cll
| Кампат (n = 147) | Хлорамбуцил (n = 147) | ||||
| Всички степени † % | 3-4 % | Всички степени % | 3-4 % | ||
| Нарушения в кръвта и лимфната система | Лимфопения | 97 | 97 | 9 | 1 |
| Неутропения | 77 | 42 | 51 | 26 | |
| Анемия | 76 | 13 | 54 | 18 | |
| Тромбоцитопения | 71 | 13 | 70 | 14 | |
| Общи разстройства и условия на администрация | Пирексия | 69 | 10 | 11 | 1 |
| Втрисане | 53 | 3 | 1 | 0 | |
| Инфекции и Infestations | CMV Viremia ‡ | 55 | 4 | 8 | 0 |
| CMV инфекция | 16 | 5 | 0 | 0 | |
| Други инфекции | 74 | 21 | 65 | 10 | |
| Кожни и подкожни тъканни нарушения | Уртикария | 16 | 2 | 1 | 0 |
| Обрив | 13 | 1 | 4 | 0 | |
| Еритема | 4 | 0 | 1 | 0 | |
| Съдови нарушения | Хипотония | 16 | 1 | 0 | 0 |
| Хипертония | 14 | 5 | 2 | 1 | |
| Нарушения на нервната система | Главоболие | 14 | 1 | 8 | 0 |
| Тремор | 3 | 0 | 1 | 0 | |
| Дихателни гръдни и медиастинални разстройства | Диспнея | 14 | 4 | 7 | 3 |
| Стомашно -чревни разстройства | Диария | 10 | 1 | 4 | 0 |
| Психиатрични разстройства | Безсъние | 10 | 0 | 3 | 0 |
| Безпокойство | 8 | 0 | 1 | 0 | |
| Сърдечен Disorders | Тахикардия | 10 | 0 | 1 | 0 |
| * Нежелани реакции, възникващи при по -висока относителна честота в рамото на Кампат † NCI CTC версия 2.0 за нежелани реакции; NCI CTCAE Версия 3.0 за лабораторни стойности ‡ CMV виремия (без данни за симптоми) включва и двата случая на единични резултати от PCR положителни тестове и потвърдена CMV виремия (≥2 случая в последователни проби на разстояние 1 седмица). За последния ганцикловир (или еквивалент) е иницииран на протокол. |
По -рано лекувани пациенти
Допълнителна информация за безопасността е получена от 3 проучвания на единични ARM от 149 пациенти, лекувани преди това с CLL, прилагани 30 mg кампур интравенозно три пъти седмично в продължение на 4 до 12 седмици (средна кумулативна доза 673 mg [диапазон 2-1106 mg]; средна продължителност на терапията 8,0 седмици). Нежеланите реакции в тези проучвания, които не са изброени в таблица 1, които се появяват при честота на заболеваемост> 5% са умора на гадене емезис мускулно -скелетна болка анорексия дизестезия мукозит и бронхоспазъм.
Имуногенност
Както при всички терапевтични протеини, има потенциал за имуногенност. Честотата на образуването на антитела е силно зависима от чувствителността и специфичността на анализа. Освен това наблюдаваната честота на антитялото (включително неутрализиращото антитяло) положителност в анализ може да бъде повлияна от няколко фактора, включително анализ на методологията на пробата за обработка на проби от проби за събиране на проби, съпътстващи лекарства и основно заболяване. Поради тези причини сравнението на честотата на антителата с честотата на антителата с други продукти на алемтузумаб може да бъде подвеждащо.
Използването на ELISA анализ на античовешки антитела (HAHA) е открит при 11 от 133 (8,3%) нелекувани по-рано пациенти. В допълнение двама пациенти са слабо положителни за неутрализиране на активността. Ограничените данни предполагат, че антисампатните антитела не са повлияли неблагоприятно на туморния отговор. Четирима от 211 (1,9%) по -рано лекувани пациенти са установени, че имат антитела към кампуса след лечение.
Опит за постмаркетиране
Кампат
Следните нежелани реакции са идентифицирани по време на използването на Campath след придружител. Тъй като тези реакции се отчитат доброволно от популация с несигурен размер, не винаги е възможно надеждно да се оцени тяхната честота или да се установи причинно -следствена връзка с експозицията на лекарства.
Общи разстройства и условия на администрация: Фатални реакции, свързани с инфузия.
Сърдечно -съдови нарушения: Застойна сърдечна недостатъчност Кардиомиопатията намалява фракцията на изхвърляне (някои пациенти са били лекувани преди това с кардиотоксични средства).
Цереброваскуларни нарушения: Цервикоцефален артериален дисекционен инсулт, включително хеморагичен и исхемичен инсулт.
Стомашно -чревни разстройства: Остър аквалкулен холецистит.
Нарушения на имунната система: Синдромът на Goodpasture's Syndrome Graves Aplastic Anemia Guillain-Barré Синдром на хронична възпалителна демиелинизираща полирадикулоневропатия Серумна болест Фатална трансфузия, свързана с присадка срещу гостоприемна болест Хемофагоцитна лимфохистиоцитоза (HLH).
Инфекции: Инфекция на вируса на Epstein-Barr (EBV) прогресираща мултифокална левкоенцефалопатия (PML) реактивиране на латентни вируси.
Метаболизъм и разстройства на храненето: Синдром на тумор лизис.
Неоплазми: Лимфопролиферативно разстройство, свързано с EBV.
Нарушения на нервната система: Оптична невропатия.
Бъбречни и уринарни разстройства: Гломерулни нефропатии.
Други продукти на Alemtuzumab
Следните нежелани реакции са идентифицирани по време на използването на друг продукт Alemtuzumab. Тъй като тези реакции се отчитат доброволно от популация с несигурен размер, не винаги е възможно надеждно да се оцени тяхната честота или да се установи причинно -следствена връзка с експозицията на лекарства.
Ендокринни разстройства:
Нарушения на нервната система: Автоимунен енцефалит.
Лекарствени взаимодействия за Кампат
Не са проведени официални проучвания за взаимодействие с лекарства с Кампат.
Предупреждения за Кампат
Включени като част от ПРЕДПАЗНИ МЕРКИ раздел.
Предпазни мерки за Кампат
Цитопении
Съобщава се за тежки, включително фатална автоимунна анемия и тромбоцитопения и продължителна миелосупресия при пациенти, получаващи кампус.
В допълнение, след лечение с препоръчителната доза при препоръчителната доза се съобщава хемолитична анемия и аплазия на аплазия на костен мозък на червените клетки. Единичните дози на Campath по -големи от 30 mg или кумулативни дози над 90 mg седмично увеличават честотата на паситопения.
Задържайте кампуса за тежки цитопении (с изключение на лимфопения). Прекратяване на автоимунни цитопении или повтарящи се/персистиращи тежка цитопения (с изключение на лимфопения) [виж Доза и приложение ]. No data exist on the safety of Кампат resumption in patients with autoimmune cytopenias or marrow aplasia [see Нежелани реакции ].
Получаване на пълна кръвна картина (CBC) на седмични интервали по време на терапия на Кампат и по -често, ако се появи влошаване на анемията Неутропения или тромбоцитопения. Оценете броя на CD4 след лечение до възстановяване до ≥200 клетки/μL [виж Доза и приложение и Нежелани реакции ].
Колко милиграма е Tylenol 3
Реакции, свързани с инфузия
Нежеланите реакции, възникващи по време или скоро след инфузия на Кампат, включват пирексия втрисане/строгост гадене хипотония уртикария диспнея обрив и бронхоспазъм [виж Нежелани реакции ]. In clinical trials the frequency of infusion-related reactions was highest in the first week of treatment. Monitor for the signs и symptoms listed above и withhold infusion for Grade 3 or 4 infusion-related reactions.
Следните сериозни, включително фатални реакции, свързани с инфузия, са идентифицирани в доклади за постмаркетиране: Синкоп белодробни инфилтрати остри респираторен дистрес синдром (ARDS) Респираторно спиране Сърдечен аритмии миокарден инфаркт Остър сърдечен недостатък Сърдечен арест Ангиоедем и анафилактоиден шок.
Инициирайте Кампат според препоръчителната схема за доза-ескалация [виж Доза и приложение ]. Premedicate patients with an antihistamine и acetaminophen prior to each dose. Institute appropriate medical management (e.g. glucocorticoids epinephrine meperidine) for infusion-related reactions as needed [see Доза и приложение ]. If therapy is interrupted for 7 or more days reinstitute Кампат with gradual dose escalation [see Доза и приложение ].
Имуносупресия/инфекции
Кампат treatment results in severe и prolonged lymphopenia with a concomitant increased incidence of opportunistic infections [see Нежелани реакции ]. Administer PCP и herpes viral prophylaxis during treatment with Кампат и for a minimum of 2 months after completion of Кампат or until the CD4+ count is ≥200 cells/μL whichever occurs later [see Доза и приложение ]. Prophylaxis does not eliminate these infections.
Рутинно следете пациентите за CMV инфекция по време на лечението с Campath и поне 2 месеца след приключване на Campath. Задържайте Campath за сериозни инфекции и по време на антивирусно лечение на CMV инфекция или потвърдена CMV виремия (дефинирана като полимеразна верижна реакция [PCR] положителна CMV в ≥2 последователни проби, получени на разстояние 1 седмица). Иницииране на терапевтичен ганцикловир (или еквивалент) за CMV инфекция или потвърдена CMV виремия.
Съобщава се за инфекция на вируса на Epstein-Barr (EBV), включваща тежък и фатален EBV-асоцииран хепатит при пациенти, които са получили кампус.
Монитор за признаци и симптоми на EBV инфекции. Задържайте Campath за реактивиране на EBV или тежка инфекция.
Прилагайте само облъчени кръвни продукти, за да се избегне свързаната с трансфузия присадка срещу болест на гостоприемника (TAGVHD), освен ако възникващите обстоятелства не диктуват незабавно преливане.
При пациенти, които са получили кампота като първоначална терапия възстановяване на броя на CD4 до ≥200 клетки/μL, се наблюдава до 6 месеца след приключване на Campath; Въпреки това на 2 месеца след лечението средната е 183 клетки/μL. При по -рано лекувани пациенти, които са получавали кампат, средното време за възстановяване на броя на CD4 до ≥200 клетки/μL е 2 месеца; Въпреки това пълното възстановяване (до изходното ниво) на броя на CD4 и CD8 може да отнеме повече от 12 месеца [виж Нежелани реакции ].
Имунизация
Безопасността на имунизацията с живи вирусни ваксини след терапия на Кампат не е проучена. Не прилагайте живи вирусни ваксини на пациенти или бебета, родени на пациенти, получаващи кампус. Способността за генериране на имунен отговор на всяка ваксина след терапия на Кампат не е проучена.
Неклинична токсикология
Канцерогенеза мутагенеза Нарушаване на плодовитостта
Не са проведени проучвания за оценка на канцерогенния или генотоксичен потенциал на Кампат.
При изследвания на плодовитостта алемтузумаб (3 или 10 mg/kg интравенозно) се прилага на HUCD52 трансгенни мъжки мишки в 5 последователни дни преди съвместното съжителство с нетретирани жени от див тип. Не се наблюдава ефект върху плодовитостта или репродуктивната ефективност. Въпреки това неблагоприятните ефекти върху параметрите на сперматозоидите (включително анормална морфология [отделена/без глава] и намалена обща броя и подвижност) се наблюдават при двете тествани дози.
Когато алемтузумаб (3 или 10 mg/kg интравенозно) се прилага на HUCD52 трансгенни женски мишки в продължение на 5 последователни дни преди съвместното съжителство с нетретирани мъже от див тип, се наблюдава намаление на средния брой на загубата на корпора и имплантационните обекти и увеличение на дозимплантацията.
Използване в конкретни популации
Бременност
Обобщение на риска
Въз основа на откритията от изследвания на животни, които Кампат може да причини вреда на плода, когато се прилага на бременна жена. Наличните данни от публикувани кохортни проучвания при бременни жени са недостатъчни за установяване на свързан с Кампат риск от големи вродени дефекти спонтанен аборт или неблагоприятни резултати от майката или плода. Алемтузумаб е ембриолетален при бременни HUCD52 трансгенни мишки, когато се прилага по време на органогенеза (виж Данни ). Известно е, че човешките IgG антитела пресичат плацентарната бариера; Следователно Кампат може да бъде предаден от майката на развиващия се плод. Посъветвайте жените за потенциалния риск за плода. Бебета, родени от бременни жени, лекувани с Кампат, могат да бъдат изложени на повишен риск от инфекция (виж Клинични съображения ).
Основният риск от големи вродени дефекти и спонтанен аборт за посоченото население е неизвестен. Всички бременности имат основен риск от загуба на вроден дефект или други неблагоприятни резултати. В общата популация на САЩ прогнозният фонов риск от големи вродени дефекти и спонтанен аборт в клинично признатите бременности е съответно 2% до 4% и 15% до 20%.
Клинични съображения
Фетални/неонатални нежелани реакции
Моноклоналните антитела се транспортират през плацентата, тъй като бременността напредва с най -голямото количество, прехвърлено през третия триместър. Помислете за рисковете и ползите от администрирането на живи или аменни на живо ваксини на бебета, изложени на кампуса в матката [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ ].
Данни
Данни за животните
Когато алемтузумаб се прилага на бременни HUCD52 трансгенни мишки по време на органогенеза (гестационни дни [GD] 6-10 или GD 11-15) при интравенозни дози от 3 или 10 mg/kg не тератогенни ефекти. Въпреки това се наблюдава увеличаване на ембриолеталността (повишена загуба на постмаплантация и броя на язовирите с всички плодове мъртви или резорбирани) при бременни животни, дозирани по време на GD 11-15. В отделно проучване при бременна HUCD52 трансгенни мишки прилагане на алемтузумаб по време на органогенеза (GD 6-10 или GD 11-15) при интравенозни дози от 3 или 10 mg/kg намаления при B-лимфоцитните и Т-лимфоцитни популации.
При бременни HUCD52 трансгенни мишки прилагат алемтузумаб при интравенозни дози от 3 или 10 mg/kg/ден през целия бременност и лактация, се наблюдава увеличение на смъртните случаи на PUP през периода на лактация при 10 mg/kg. Намаляване на популациите на Т-лимфоцити и В-лимфоцити и в реакцията на антитела се наблюдават при потомство при тествани от двете дози.
Лактация
Обобщение на риска
Няма данни за наличието на алемтузумаб в ефектите на човешкото мляко върху производството на мляко или кърменото дете. Ефектите от локалната стомашно -чревна експозиция и ограничената системна експозиция при кърмене на алемтузумаб са неизвестни. Алемтузумаб е открит в млякото на лактиращи HUCD52 трансгенни мишки, прилагани алемтузумаб (виж Данни ). Maternal IgG is known to be present in human milk и when a drug is present in animal milk it is likely that the drug will be present in human milk.
Поради потенциала за сериозни нежелани реакции от Кампат при кърмено дете, включително намален брой на лимфоцитите, съветват да се кърмим жените да не кърмят по време на лечението с Кампат и поне 3 месеца след последната доза.
Данни
Алемтузумаб се открива в млякото на лактиращи HUCD52 трансгенни мишки след интравенозно приложение на алемтузумаб в доза 10 mg/kg в следродилни дни 8-12. Серумните нива на алемтузумаб са сходни при кърмене на мишки и потомство на ден 13 след раждането и са свързани с данни за фармакологична активност (намаляване на броя на лимфоцитите) в потомството.
Жени и мъже с репродуктивен потенциал
Кампат may cause embryo-fetal harm when administered to pregnant women [see Използване в конкретни популации ].
Бременност Testing
Бременност testing is recommended for females of reproductive potential prior to initiating Кампат therapy.
Контрацепция
Жени
Консултирайте женските пациенти с репродуктивен потенциал да използват ефективна контрацепция по време на лечението с Кампат и поне 3 месеца след последната доза.
Безплодие
Въз основа на откритията от проучвания върху животни alemtuzumab може да наруши плодовитостта при жените и мъжете с репродуктивен потенциал [виж Неклинична токсикология ]. The reversibility of the effect on fertility is unknown.
Има ли фиорицет аспирин в него
Педиатрична употреба
Безопасността и ефективността на Campath не са установени при педиатрични пациенти.
Гериатрична употреба
От 147 нелекувани по-рано пациенти с В-CLL, лекувани с Кампат 35%, са ≥ 65-годишна възраст и 4% са ≥ 75-годишна възраст от 149 пациенти, лекувани преди това с B-Cll 44%, са на възраст ≥65 години, а 10% са на възраст ≥75 години. Клиничните проучвания на Campath не включват достатъчен брой субекти на възраст 65 и повече години, за да се определи дали реагират по различен начин от по -младите лица. Други отчетени клиничен опит не са установили разлики в отговорите между възрастни и по -млади пациенти.
Информация за предозиране за Кампат
Във целия клиничен опит отчетената максимална получена единична доза е 90 mg. Инфекции с аплазия на костен мозък или тежки реакции, свързани с инфузия, се наблюдават при пациенти, които са получили доза по-висока от препоръчителната.
Един пациент, който е получил доза 80 mg, интравенозно е имал остра бронхоспазъм кашлица и диспнея, последвана от анурия и смърт. Друг пациент получи две 90 mg дози интравенозно един ден един от друг през втората седмица на лечение и изпита бързо начало на аплазия на костния мозък.
Няма известен специфичен антидот за предозиране на Кампат. Прекратяване на Кампат и осигурете поддържаща терапия.
Противопоказания за Кампат
Няма.
Клинична фармакология for Campath
Механизъм на действие
Кампат binds to CD52 an antigen present on the surface of B и T lymphocytes a majority of monocytes macrophages NK cells и a subpopulation of granulocytes. A proportion of bone marrow cells including some CD34+ cells express variable levels of CD52. The proposed mechanism of action is antibody-dependent cellular-mediated lysis following cell surface binding of Кампат to the leukemic cells.
Фармакодинамика
Сърдечен Electrophysiology
Ефектът на множество дози алемтузумаб (12 mg/ден в продължение на 5 дни) върху QTC интервала е оценен в едно железопътно проучване при 53 пациенти без злокачествено заболяване. В проучването не бяха открити големи промени в средния QTC интервал (т.е.> 20 ms). Средно увеличение на сърдечната честота от 22 до 26 удара/мин се наблюдава поне 2 часа след първоначалната инфузия на алемтузумаб. Това увеличение на сърдечната честота не се наблюдава при последващи дози.
Acetami/кодеин 300-30mg
Фармакокинетика
Кампат pharmacokinetics were characterized in a study of 30 previously treated B-CLL patients in whom Кампат was administered at the recommended dose и schedule. After 12 weeks of dosing patients exhibited a 7-fold increase in mean AUC.
Разпределение
След последната доза 30 mg средният обем на разпределение в стационарно състояние е 0,18 L/kg (диапазон от 0,1 до 0,4 L/kg).
Елиминиране
Кампат pharmacokinetics displayed nonlinear elimination kinetics. Systemic clearance decreased with repeated administration due to decreased receptor-mediated clearance (i.e. loss of CD52 receptors in the periphery). Mean half-life was 11 hours (range 2 to 32 hours) after the first 30 mg dose и was 6 days (range 1 to 14 days) after the last 30 mg dose.
Специфични популации
Ефектите от бъбречно или чернодробно увреждане върху фармакокинетиката на Кампат не са проучени.
Клинични изследвания
Преди това нелекувани B-Cll пациенти
Кампат was evaluated in an open-label rиomized (1:1) active-controlled study in previously untreated patients with B-CLL Rai Stage I-IV with evidence of progressive disease requiring therapy. Patients received either Кампат 30 mg intravenously 3 times per week for a maximum of 12 weeks or chlorambucil 40 mg/m² orally once every 28 days for a maximum of 12 cycles.
Of the 297 patients randomized the median age was 60 years 72% were male 99% were Caucasian 96% had a WHO performance status 0-1 23% had maximum lymph node diameter ≥5 cm 34% were Rai Stage III/IV and 8% were treated in the U.S.
Пациентите, рандомизирани да получават Campath, преживяват по -дълга преживяемост без прогресия (PFS) в сравнение с тези, които са рандомизирани да получават хлорамбуцил (медиана PFS съответно 14,6 месеца срещу 11,7 месеца). Общият процент на отговор беше 83% и 55% (p <0.0001) и the complete response rates were 24% и 2% (p <0.0001) for Кампат и chlorambucil arms respectively. The Kaplan-Meier curve for PFS is shown in Figure 1.
Фигура 1: Преживяване без прогресия при нелекувани по-рано пациенти с B-Cll*
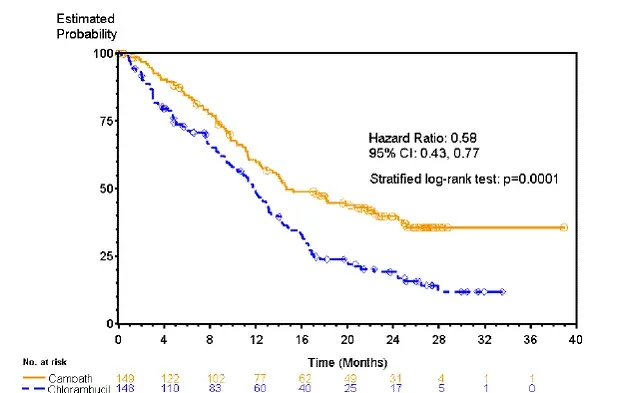 |
* Тест за лог-ранг, коригиран за етап RAI (I-II срещу III-IV).
Преди това лекувани пациенти с B-Cll
Кампат was evaluated in three multicenter open-label single-arm studies of 149 patients with B-CLL previously treated with alkylating agents fludarabine or other chemotherapies. Patients were treated with the recommended dose of Кампат 30 mg intravenously 3 times per week for up to 12 weeks. Partial response rates of 21% to 31% и complete response rates of 0% to 2% were observed.
Информация за пациента за Кампат
Цитопении
Посъветвайте пациентите да съобщават за всякакви признаци или симптоми като кървене лесни синини Petechiae или Purpura Palor Falone или умора [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ и Нежелани реакции ].
Реакции, свързани с инфузия
Посъветвайте пациентите за признаците и симптомите на реакции, свързани с инфузия, и на необходимостта от приемане ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ и Нежелани реакции ].
Имуносупресия/инфекции
Посъветвайте пациентите незабавно да съобщават симптоми на инфекция (напр. Пирексия) и да приемат профилактични антиинфективи за PCP (триметоприм/сулфаметоксазол DS или еквивалент) и за херпес вирус (фамцикловир или еквивалент), както е предписано [виж херпес ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ и Нежелани реакции ].
Съветват пациентите, че е необходимо облъчване на кръвни продукти [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ ].
Имунизация
Посъветвайте се с пациентите, че не трябва да бъдат имунизирани с живи вирусни ваксини, ако наскоро са лекувани с Campath. Посъветвайте жените с бебета, изложени на Кампат в Утеро, да информират педиатъра за експозицията [виж ПредупреждениеS AND ПРЕДПАЗНИ МЕРКИ ].
Ембрио-фетална токсичност
Посъветвайте бременните жени и жените с репродуктивен потенциал на потенциалния риск за плода. Съветват жените да информират своя доставчик на здравни грижи за известна или заподозряна бременност [виж Използване в конкретни популации ].
Консултирайте женските пациенти с репродуктивен потенциал да използват ефективна контрацепция по време на лечение с Кампат и в продължение на 3 месеца след крайната доза [виж Използване в конкретни популации ].
Лактация
Посъветвайте жените да не кърмят по време на лечението с Кампат и в продължение на 3 месеца след крайната доза [виж Използване в конкретни популации ].
Безплодие
Съветват жените и мъжете с репродуктивен потенциал, че Кампат може да наруши плодовитостта [виж Използване в конкретни популации и Неклинична токсикология ].
Гломерулни нефропатии
Посъветвайте пациентите за признаци и симптоми на гломерулни нефропатии, които могат да се появят месеци до години след получаване на Кампат [виж Нежелани реакции ].